Belite Bio presentó los resultados provisionales de 12 meses del ensayo clínico de fase 1b/2 Tinlarebant (LBS-008) para adolescentesen con la enfermedad de Stargardt1
LBS-008 (también conocido como Tinlarebant) fue seguro y bien tolerado en sujetos adolescentes con la enfermedad de Stargardt (STGD1) a los 12 meses.
La mayoría de los participantes mostraron una estabilización de la visión en al menos un ojo.
Se sigue observando una tendencia a prevenir o ralentizar la expansión de la autofluorescencia.
No hay lesiones atróficas (DDAF) en 12 de 13 sujetos en el periodo de tratamiento de 12 meses.
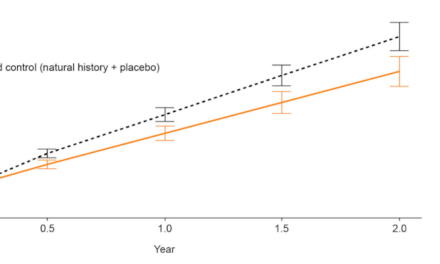
Los datos provisionales a los 12 meses del estudio de fase 2 en curso siguen mostrando una estabilización en varios parámetros, como la detención o ralentización del crecimiento de la lesión, la conservación del grosor de la retina, la reducción de la anchura del defecto de la zona elipsoide (EZ) y la estabilización de la agudeza visual.
Belite Bio, Inc., una empresa de desarrollo de fármacos biofarmacéuticos en fase clínica con sede en San Diego, cuyo objetivo son las enfermedades oculares actualmente sin tratamiento, ha presentado hoy los datos de un año de su estudio clínico en curso de fase 2 de Tinlarebant en STGD1 como parte de la serie de presentaciones orales en la Reunión Anual de la Academia Americana de Oftalmología (AAO) que se celebró del 30 de septiembre al 3 de octubre de 2022 en McCormick Place, Chicago.
Hasta la fecha, los 13 pacientes han completado un año de tratamiento en el estudio en curso de fase 2 de Tinlarebant, de dos años de duración. Se han recogido los resultados de las evaluaciones de seguridad y tolerabilidad, así como datos de imágenes de la retina para la evaluación de la progresión de la enfermedad. Las imágenes de la tomografía de coherencia óptica de dominio espectral, una modalidad de imagen que permite visualizar la anatomía de la retina, han mostrado una estabilización del grosor de la retina en muchos participantes. Las imágenes de autofluorescencia del fondo de ojo no muestran expansión de la autofluorescencia (QDAF) en 7 de 13 (53,8%) sujetos, y 12 de 13 (92,3%) participantes tampoco muestran lesión atrófica (DDAF) después de un año de tratamiento. Y lo que es más importante, 9 de 13 (69,2%) participantes muestran una estabilización o mejora de la agudeza visual a lo largo del periodo de tratamiento de un año. Una copia de las diapositivas de la presentación está disponible en https://investors.belitebio.com/aao-presentation-download-form.
Según el estudio prospectivo internacional del STGD1 (el estudio ProgStar), los pacientes de inicio infantil sin lesión atrófica (DDAF) al inicio del tratamiento experimentaron una tasa media de crecimiento de la lesión de 0,66 mm2 para los ojos izquierdos y de 0,74 mm2 para los ojos derechos al cabo de un año. Además, el Prospective Cohort Study of Childhood-Onset Stargardt Disease (Estudio de cohorte prospectivo de la enfermedad de Stargardt de inicio en la infancia) de Georgiou et al. informó de una tasa media de crecimiento de la lesión atrófica (DDAF) de 0,69 mm2/año en los niños. Los datos de Belite Bio a un año del estudio de fase 2 en curso mostraron una tasa media de crecimiento de las lesiones de 0,03 mm2/año, lo que demuestra una tendencia prometedora hacia la detención o ralentización de la progresión de la enfermedad en la cohorte del estudio.
«Estamos muy animados por los resultados del tratamiento a 12 meses de nuestro estudio de fase 2. Mientras que la progresión natural del STGD1 de inicio en la infancia se caracteriza por un rápido declive visual y una rápida progresión de la enfermedad que lleva a la pérdida visual permanente a una edad muy temprana, los datos provisionales de la Fase 2 han mostrado la estabilización en varios parámetros estructurales y funcionales», dijo el Dr. Tom Lin.
Belite Bio está realizando actualmente un estudio de fase 2 de dos años y un estudio de fase 3 de dos años (DRAGON) de Tinlarebant en sujetos adolescentes con STGD1. Belite Bio espera que la próxima lectura de datos en su estudio de fase 2 de STGD1 se produzca durante el segundo trimestre de 2023, cuando todos los participantes completen 18 meses de tratamiento.
Acerca del estudio DRAGON
El estudio de fase 3, de dos años de duración, denominado DRAGON, es un estudio multicéntrico, aleatorizado, con doble enmascaramiento y controlado con placebo para evaluar la seguridad y la eficacia de Tinlarebant en el tratamiento de la enfermedad de Stargardt en pacientes adolescentes. El estudio DRAGON está diseñado para evaluar la seguridad y la eficacia de Tinlarebant en pacientes adolescentes con ETS1. Hasta la fecha, Belite Bio ha iniciado el estudio de fase 3 en Estados Unidos, Reino Unido, Alemania, Bélgica, Suiza, Hong Kong, Taiwán, China continental y Australia. El objetivo es inscribir a unos 60 pacientes en este estudio con una aleatorización 2:1 (activo:placebo). Para más información, visite clinicaltrials.gov en https://www.clinicaltrials.gov/ct2/show/NCT05244304?term=belite+bio&draw=2&rank=1)
Acerca de LBS-008 (también conocido como Tinlarebant)
Tinlarebant es un nuevo tratamiento oral que previene la acumulación de toxinas en el ojo que causan el STGD1 y contribuyen a la DMAE seca avanzada (atrofia geográfica). Estas toxinas son subproductos del ciclo visual, que depende del suministro de vitamina A (retinol) al ojo. El Tinlarebant actúa reduciendo y manteniendo los niveles de la proteína sérica de unión al retinol 4 (RBP4), una proteína portadora que transporta el retinol al ojo. Al modular la cantidad de retinol que entra en el ojo, Tinlarebant reduce la formación de toxinas que han sido implicadas en el STGD1 y la DMAE seca. Tinlarebant ha recibido la designación de vía rápida y de enfermedad pediátrica rara en los Estados Unidos, y la designación de medicamento huérfano en los Estados Unidos y Europa para el tratamiento de la STGD1.
Enfermedad de Stargardt
La enfermedad de Stargardt1 es la distrofia hereditaria de la retina más común (que causa visión borrosa o pérdida de la visión central) tanto en adultos como en niños. La enfermedad está causada por un gen disfuncional específico de la retina (ABCA4) que da lugar a una acumulación masiva de subproductos tóxicos de la vitamina A (conocidos como «bisretinoides») en la retina, lo que provoca la muerte de las células de la retina y la pérdida progresiva de la visión central. Las propiedades fluorescentes de los bisretinoides y el desarrollo de imágenes de la retina han ayudado a los oftalmólogos a identificar y controlar la progresión de la enfermedad. Es importante destacar que la STGD1 y la DMAE seca comparten una fisiopatología similar que se caracteriza por la acumulación excesiva de bisretinoides citotóxicos, la muerte de las células de la retina y la pérdida de visión. La pérdida de visión se produce lentamente, a pesar de la expansión periférica de la «retina muerta», hasta que la enfermedad alcanza el centro del ojo (la mácula).
Degeneración macular seca asociada a la edad
La DMAE seca es una de las principales causas de pérdida de visión en EE.UU. y no dispone de tratamientos aprobados. Se calcula que hay 11 millones de pacientes con DMAE seca en EE.UU. y más de 196 millones en todo el mundo, con un coste sanitario directo estimado en 255.000 millones de dólares.
Resultados 12 meses ensayo clínico Tinlarebant (LBS-008) para adolescentes con Stargardt1
Traducción: Asociación Mácula Retina
Fuente