SparingVision culmina la fase final de escalado de dosis en el ensayo PRODYGY con SPVN06 para la retinosis pigmentaria
• Se han observado patrones favorables de seguridad y tolerabilidad con las dos primeras dosis de SPVN06 en seis pacientes (tres pacientes por cohorte).
• El estudio de SPVN06 para atrofia geográfica comenzará en 2024.
SparingVision, una destacada empresa de medicina genómica en fase clínica que redefine el tratamiento de las enfermedades de la retina, anuncia un avance crucial en su ensayo clínico de Fase I/II (PRODYGY, NCT05748873) para SPVN06. Líder en investigación agnóstica de terapia genica para la retinosis pigmentaria (RP), la compañía ha avanzado a la cohorte de aumento de dosis (Parte 1). La recomendación positiva de la Junta de Control de Seguridad de Datos (DSMB) es un paso clave hacia la parte controlada del estudio (Parte 2), programada para iniciar en el segundo trimestre de 2024 según el cronograma de desarrollo del estudio.
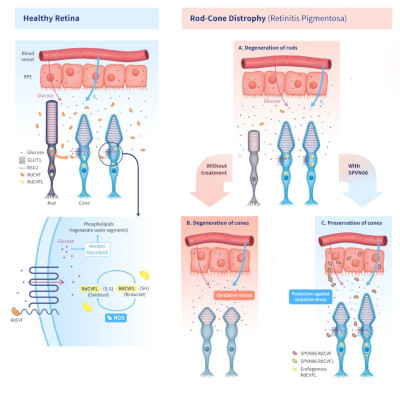
SPVN06 representa un enfoque innovador de terapia génica diseñado para frenar o disminuir la progresión de la distrofia de conos y bastones (RCD) en pacientes, independientemente de sus antecedentes genéticos. Inicialmente, SparingVision concentra sus esfuerzos en la retinosis pigmentaria (RP) en etapa intermedia, una de las principales causas hereditarias de ceguera a nivel mundial.
Este avance en el ensayo PRODYGY hacia la tercera cohorte, con la dosis más elevada de SPVN06, se realiza siguiendo la recomendación positiva de la DSMB, la cual aprobó la administración de la dosis media a la segunda cohorte en agosto de 2023. Ambas recomendaciones favorables de la DSMB se fundamentan en los perfiles de seguridad y tolerabilidad favorables observados en pacientes tratados con las dosis más bajas (primera cohorte) y medias (segunda cohorte) de SPVN06.
Tras completar la tercera y última cohorte de la Parte 1, la compañía tiene previsto avanzar el ensayo PRODYGY a la Parte 2. Esta fase, que será una extensión aleatoria, doble enmascarada y controlada, involucrará tres grupos: dos recibirán distintas dosis de SPVN06 y uno será el grupo de control sin tratamiento, con ubicación en Estados Unidos. La expectativa es alcanzar el criterio de valoración principal del ensayo PRODYGY Fase I/II en la segunda mitad de 2025, doce meses después de la administración de la dosis al último paciente de la Parte 2.
Stéphane Boissel, presidente y director ejecutivo de SparingVision, dijo: “Nos complace ver el sólido perfil de seguridad y tolerabilidad de SPVN06 hasta ahora. Este hito no solo nos permite avanzar a la dosis más alta y, con la esperanza de recibir otra recomendación positiva de la DSMB, iniciar la Parte 2 en el segundo trimestre de 2024, sino que también nos da la confianza para ampliar la evaluación de SPVN06 en atrofia geográfica (GA), otra causa importante de ceguera. Estamos emocionados por el futuro mientras continuamos desarrollando nuestra cartera de medicamentos genómicos pioneros para preservar la visión”.
Con los datos alentadores de seguridad recabados en PRODYGY hasta la fecha, respaldados por evidencia y conocimientos de expertos (KOL Insight), SparingVision confía en el gran potencial de SPVN06 para abordar otras enfermedades de la retina en las cuales la preservación de los conos es esencial para frenar la progresión de la enfermedad. La compañía tiene la intención de explorar los beneficios de su terapia génica en el tratamiento de la atrofia geográfica (GA), con miras a iniciar posiblemente estudios que permitan la presentación de una nueva investigación de fármacos (IND) para la atrofia geográfica (GA) en 2024.
PRODYGY (Promising ROd-cone DYscracy Gene therapY) es un ensayo multicéntrico de fase I/II diseñado para evaluar la seguridad, tolerabilidad, eficacia preliminar y calidad de vida tras una única inyección subretiniana de SPVN06 en el ojo con menor visión de adultos con RCD causada por mutaciones en los genes RHO, PDE6A o PDE6B. El estudio busca reclutar un total de 33 pacientes en dos partes:
Parte 1: fase abierta de aumento de dosis, que consta de tres cohortes de tres pacientes con RCD avanzada grave, con el propósito de determinar las dosis recomendadas mejor toleradas para la Segunda Parte.
Parte 2: fase de extensión controlada, doble enmascarada y aleatorizada, con la participación de 24 pacientes con RP intermedia avanzada. Estos se dividen en tres cohortes: seis no tratados y 18 que recibieron una de las dos dosis recomendadas determinadas en la Primera Parte.
Para obtener más información sobre el ensayo, visite: www.ClinicalTrials.gov (identificador CT: NCT05748873).
SparingVision culmina la fase final de escalado de dosis en el ensayo PRODYGY con SPVN06 para la retinosis pigmentaria
Traducción: Asociación Mácula Retina
Fuente