2023: El año de la atrofia geográfica. Una revisión exhaustiva de 87 programas clínicos de tratamientos para la retina
2022 fue un año destacado por la introducción de los primeros biosimilares estadounidenses para la retina, junto con la aprobación de faricimab.
Claves importantes
El listado de este año incluye 21 programas que no figuraban en años anteriores.
Se han añadido nuevos nombres para varios tratamientos en investigación.
Dos programas han sido eliminados de la lista de este año: FHTR2163, también conocido como galegenimab o RG6147, y abicipar pegol.
Cuando usted lea esto, es posible que la Food and Drug Administration ya haya aprobado el pegcetacoplan como primer tratamiento para la atrofia geográfica secundaria a la degeneración macular asociada a la edad. O no. Uno de los matices de las revistas es cubrir un acontecimiento semanas o días antes de que se produzca.
En cualquier caso, 2023 se perfila como el año de la atrofia geográfica (AG), protagonizado por el mencionado pegcetacoplan (Apellis Pharmaceuticals). Y en diciembre de 2022, Iveric Bio completó la presentación de su solicitud de nuevo fármaco para avacincaptad pegol, lo que puede sentar las bases para la acción de la FDA este año.
La lista de este año incluye 87 tratamientos en fase de investigación o que pronto entrarán en ensayos clínicos en seis categorías diferentes:
- Degeneración macular neovascular asociada a la edad, edema macular diabético, retinopatía diabética y oclusión venosa de la retina.
- Atrofia geográfica.
- Terapias génicas para DMAE, RD y EMD.
- Biosimilares.
- Trastornos hereditarios de la retina.
- Dispositivos.
Las categorías de tratamientos y dispositivos para la AG son nuevas. En total, la lista de este año incluye 87 candidaturas, pero no necesariamente 87 candidaturas diferentes; algunas de ellas se están investigando en diferentes ensayos para diferentes indicaciones y aparecen dos veces en la lista.
Altas y bajas
Algunos medicamentos reciben nuevos nombres. Tarcocimab tedromer es el nuevo nombre que Kodiak Sciences ha dado al KSI-301. Tinlarebant es el nombre que Belite Bio da al LBS-008. Y así sucesivamente.
La lista de este año incluye 21 nuevos productos, entre ellos seis biosimilares que no figuraban en la lista y cuatro tratamientos para enfermedades hereditarias y candidatos a terapia génica para nDMAE, EMD y RD.
El año 2022 fue conocido por importantes aprobaciones, como Vabysmo (faricimab, Genentech/Roche) y Cimerli, el biosimilar de ranibizumab de Coherus Biosciences. También cabe destacar en el ámbito de los biosimilares el lanzamiento por Biogen de Byooviz, aprobado en 2021.
Clearside Biomedical y Bausch + Lomb también lanzaron Xipere, la suspensión supracoroidal de acetónido de triamcinolona, para el edema macular uveítico. Permanece en la lista porque los promotores están llevando a cabo un programa para el EMD.
Algunos candidatos de la lista del año pasado no están en la de este año. FHTR2163, también conocido como galegenimab o RG6147, se eliminó porque Roche informó el año pasado de que interrumpiría el programa. Abicipar pegol se eliminó porque Molecular Partners no ha emitido ninguna actualización sobre el agente.
¿Biosimilar o no?
ONS-5010/Lytenava aparece en la tabla grande de tratamientos de nDMAE, DME, DR, RVO en lugar de biosimilares, aunque en realidad es un biosimilar de Avastin (bevacizumab, Genentech/Roche). La razón: si se aprueba, sería la primera formulación oftálmica de bevacizumab, mientras que el producto de referencia lo preparan farmacias especializadas a partir de lotes del medicamento contra el cáncer. La FDA fijó una fecha de actuación para agosto.
Agentes en investigación para nDMAE, EMD, RD y RVO
Aflibercept de dosis alta (Regeneron Pharmaceuticals)
Dos ensayos pivotales de esta nueva formulación de aflibercept de 8 mg, conocida como aflibercept de dosis alta (el aflibercept de 2 mg se comercializa como Eylea), cumplieron sus criterios de valoración primarios. Los ensayos PHOTON, en edema macular diabético, y PULSAR, en degeneración macular neovascular asociada a la edad, demostraron que las dosis de aflibercept 8 mg a las 12 y 16 semanas no eran inferiores en cuanto al aumento de la visión en comparación con la dosis de aflibercept 2 mg a las 8 semanas. Regeneron y Bayer, que tiene la franquicia de aflibercept fuera de Estados Unidos, dicen que someterán estos datos a revisión reguladora.
AKST4290 (Alkahest)
AKST4290 es un inhibidor oral del receptor 3 de la quimioquina C-C (CCR3) que bloquea la acción de la eotaxina, una proteína inmunomoduladora que aumenta con la edad y contribuye a las enfermedades relacionadas con ella. El ensayo de fase IIb PHTHALO-205 (n=107, NCT04331730), finalizado en 2021, aleatorizó a los pacientes a 800 o 1.600 mg diarios de AKST4290 o a placebo. Todos los participantes recibieron también inyecciones de aflibercept no especificadas. El ensayo está evaluando los resultados de agudeza visual tras tres dosis de carga de aflibercept en pacientes con nDMAE sin tratamiento. De hecho, los pacientes tratados con placebo experimentaron una mejoría más acusada de la agudeza visual mejor corregida; el 41,7% mejoró en más de 15 letras a las 36 semanas, frente al 30,6% y el 14,3% en los grupos tratados con dosis bajas y altas de AKST. El cambio en el grosor del subcampo central y el tiempo transcurrido hasta la primera inyección de aflibercept (unas 20 semanas) también fueron comparables en los distintos grupos de tratamiento. Alkahest no respondió a una solicitud de información actualizada.
APX3330 (Ocuphire Pharma)
Ocuphire informó de que su ensayo de fase II ZETA-1 (n=103, NCT04692688) en pacientes con retinopatía diabética no proliferativa de moderadamente grave a grave o retinopatía diabética proliferativa leve no alcanzó su objetivo primario, pero sí los objetivos de seguridad sistémica y ocular. La empresa informa de que se está preparando para una reunión con la FDA al final de la fase II.

AR-1105, AR-13503 (Aerie Pharmaceuticals)
AR-1105 es una plataforma de implante de dexametasona para el EMD y la oclusión venosa retiniana. Un estudio abierto de seis meses de duración (n=49, NCT03739593) en pacientes con edema macular debido a OVR demostró mejoras en la AVMC. Se están preparando ensayos de fase III en EMD.
AR-13503 es un implante inhibidor de la rho-quinasa que es un metabolito activo del netarsudil. En estudios preclínicos, el AR-13503 demostró su eficacia como monoterapia y como complemento del anti-VEGF. También es objeto de un estudio de fase I en nDMAE y EMD (n=18, NCT03835884).
ALK-001 (Alkeus Pharmaceuticals)
En 2021 finalizó el reclutamiento en un ensayo de fase II/III (n=300, NCT03845582) de esta forma oral modificada de vitamina A, pero aún no se han publicado los resultados. El ALK-001 pretende sustituir la vitamina A natural del organismo por una forma que fabrica dímeros de vitamina A más lentamente y evita la formación de dímeros de vitamina A tóxicos. Está previsto que el estudio sobre la atrofia geográfica concluya a finales de año. Alkeus también está realizando ensayos simultáneos en la enfermedad de Stargardt. Alkeus no respondió a la solicitud de información actualizada.
ANX007 (Annexon Biosciences)
Annexon completó la inscripción de pacientes en el ensayo de fase II ARCHER que evalúa este candidato anticomplemento del factor 1q (n=270, NCT04656561). Annexon afirma que tiene previsto comunicar los datos iniciales sobre el criterio de valoración principal en el primer semestre de 2023, tras 12 meses de tratamiento, y que los datos completos se obtendrán una vez concluido un periodo de seis meses sin tratamiento. La finalización del estudio está prevista para finales de año.
NUEVO: Danicopan (Alexion Pharmaceuticals)
Danicopan, también conocido como ALXN2040, es un inhibidor oral del factor D que también se está investigando como tratamiento complementario de la hemoglobinuria paroxística nocturna. Un ensayo de fase II (n=332, NCT05019521) está evaluando danicopan como monoterapia para la atrofia geográfica. El ensayo se inició a finales de 2021 y está previsto que finalice en 2025.
Elamipretida (Stealth BioTherapeutics)
El estudio de fase II ReCLAIM-2 de este péptido (Elamipretida) de permeabilización celular (n=176, NCT03891875) no alcanzó sus criterios de valoración primarios: cambio en la agudeza visual de baja luminancia (AVBL) y tamaño de la lesión de AG. Pero los últimos datos demostraron una mejora de >2 líneas en la LLVA de los participantes en el estudio, resultados lo bastante prometedores como para continuar el programa, según Stealth. En general, los participantes en el estudio toleraron bien la elamipretida. La tasa de exudaciones de nueva aparición fue del 5,3% en el brazo de elamipretida frente al 6,9% de placebo.
IONIS-FB-LRx (Ionis Pharmaceuticals/Roche)
El estudio de IONIS-FB-LRx de fase II GOLDEN para la AG (n=330, NCT03815825) sigue reclutando pacientes. El criterio de valoración primario es el cambio en el área de atrofia geográfica en la semana 49. Los resultados secundarios miden biomarcadores clave: niveles de factor B en plasma y actividad AH50 en suero, así como LLVA. La finalización del estudio se ha retrasado hasta principios del próximo año. IONIS-FB-LRx es un inhibidor antisentido.
NGM621 (NGM Biopharmaceuticals)
NGM Biopharmaceuticals está analizando los resultados del ensayo de fase II CATALINA (n=320, NTC04465955) con NGM621 para determinar los próximos pasos de este anticuerpo monoclonal destinado a inhibir la actividad del componente 3 (C3) del complemento. El ensayo no alcanzó su objetivo primario: Una reducción estadísticamente significativa de la superficie de la lesión de la AG frente al placebo durante 52 semanas. Un análisis post hoc mostró que un subgrupo presentaba una respuesta más sólida que la población general del estudio.1 Este subgrupo tenía un rango de área de lesión de AG más estrecho que los criterios de inclusión del ensayo: de 4,17 a 9,64 mm2 frente a ≥2,5 mm2 y ≤17,5 mm2. En este subgrupo, NGM621 demostró una reducción de la tasa de cambio en el área de la lesión GA (pendiente) del 21,9 por ciento (q4 semanas) (n=55) y del 16,8 por ciento (q 8 semanas) (n=52), en comparación con sham (n=53). En breve se publicarán los resultados actualizados de CATALINA.
OpRegen (Lineage Cell Therapeutics)
Esta plataforma de trasplante celular consiste en la administración subretiniana de células alogénicas del epitelio pigmentario de la retina. Los resultados al año del ensayo de fase I/IIa en curso (NCT02286089) mostraron que los 24 pacientes tratados notificaron al menos un acontecimiento adverso (AA) y al menos un AA ocular, pero alrededor del 90 por ciento de los AA en las cuatro primeras cohortes fueron de naturaleza leve. No se notificaron casos de rechazo, inflamación intraocular aguda o retardada, ni aumentos sostenidos de la presión intraocular. Se está reclutando un estudio clínico de fase IIa, multicéntrico, abierto y de un solo brazo (n=60, NCT05626114). Genentech/Roche se ha asociado con Lineage para desarrollar OpRegen.
Pegcetacoplan (Apellis Pharmaceuticals)
El año pasado se generó una gran expectación cuando la Administración de Alimentos y Medicamentos (FDA) fijó en noviembre la fecha de presentación de la solicitud de nuevo fármaco (NDA) de Apellis para pegcetacoplan conforme a la Prescription Drug User Fee Act (PDUFA). Pero entonces Apellis retiró la solicitud para poder volver a presentarla con datos actualizados de 24 meses de los estudios de fase III DERBY (n=621, NCT03525600) y OAKS (n=637, NCT03525613). Con la NDA modificada presentada, la FDA fijó una nueva fecha de acción PDUFA para el 26 de febrero. Los datos de 24 meses mostraron que los pacientes con tratamiento mensual y bimensual perdían sensibilidad umbral media a un ritmo más lento que los pacientes con tratamiento placebo y tenían significativamente menos puntos escotomatosos que los pacientes con tratamiento placebo.1,2
El año pasado, Apellis también presentó una solicitud de autorización de comercialización a la Agencia Europea del Medicamento. Pegcetacoplan se dirige a C3.
NUEVO: RPESC-RPE-4Q (Luxa Biotechnology)
RPESC-RPE-4W consiste en células madre alogénicas del epitelio pigmentario de la retina (RPESC) aisladas de la capa del epitelio pigmentario de la retina de ojos humanos de cadáver, trasplantadas bajo la mácula. El primer paciente recibió el trasplante del producto celular en el ensayo clínico de fase I/IIa la pasada primavera (n=18, NCT04627428). El ensayo está evaluando la seguridad, la tolerabilidad, la viabilidad y la eficacia preliminar de RPESC-RPE-4W subretiniano mediante un diseño abierto de escalado de dosis. La finalización del estudio está prevista para mayo de 2025. Luxa es una empresa conjunta de Y2 Solution Co., con sede en Seúl, y el Neural Stem Cell Institute de Rensselaer (Nueva York).
Tinlarebant/LBS-008 (Belite Bio)
Belite Bio afirma haber finalizado el diseño de su ensayo clínico de fase III para la atrofia geográfica, pero el estudio aún no se ha registrado en ClinicalTrials.gov. El tinlarebant es un antagonista oral específico de la proteína de unión al retinol 4 (RBP4) de molécula pequeña. Un ensayo previo de fase I (n=71, NCT03735810) confirmó la seguridad y tolerabilidad del fármaco y que la administración oral alcanzaba un nivel potencialmente terapéutico del agente. Está en curso un ensayo de fase III en la enfermedad de Stargardt.
Xiflam (InflammX)
InflammX declaró el pasado otoño que tenía previsto iniciar a finales de año ensayos clínicos de fase IIb independientes en DMAE seca intermedia y AG con Xiflam, pero no hay ningún ensayo registrado en ClinicalTrials.gov. El año pasado presentó una modificación de medicamento nuevo en investigación que, según dijo, permitiría a la Red de Retina DRCR iniciar un ensayo de fase IIb en DME, así como en nefropatía diabética.
Zimura/ avacincaptad pegol (Iveric Bio)
Avacincaptad pegol (ACP), un inhibidor del complemento C5, parece ser el siguiente tratamiento del AG en la cola para su aprobación y comercialización. El otoño pasado, la FDA concedió a ACP la designación de terapia innovadora para la AG. En diciembre, Iveric Bio presentó a la FDA el tercer y último plazo de su NDA. La solicitud se basa en los resultados de 12 meses de los ensayos clínicos de fase II/III GATHER1 (n=286, NCT02686658) y fase III GATHER2 (n=448, NCT04435366). En ambos ensayos se asignó aleatoriamente a los pacientes 2 mg de ACP o un tratamiento placebo mensual. Los datos iniciales de GATHER2 mostraron que los pacientes tratados experimentaron una reducción del 14,3% en la tasa media de crecimiento del área de GA durante 12 meses (p=0,0064).3 En febrero se publicará una actualización del ensayo de fase III GATHER 2. Un estudio de extensión está realizando un seguimiento de los pacientes que completaron GATHER2 con 2 mg mensuales de ACP durante 18 meses (n=400, NCT05536297). El ACP también es objeto de un ensayo clínico en la enfermedad de Stargardt.

REFERENCIAS
1. Wykoff CC. Seguridad y eficacia de NGM621, un anticuerpo monoclonal contra C3 para el tratamiento de la atrofia geográfica: Resultados del estudio CATALINA de fase II. Ponencia presentada en la 55ª reunión anual de The Retina Society; Pasadena, CA; 3 de noviembre de 2022.
2. Wykoff CC. Tratamiento de la atrofia geográfica secundaria a la DMAE con pegectacoplan: Two-year outcomes from the randomized Phase III DERBY and OAKS trials. Ponencia presentada en el American Academy of Ophthalmology Retina Subspescialty Day; Chicago, IL; 30 de septiembre de 2022.
3. Khanani AM. Resultados del estudio pivotal de fase III GATHER2: Eficacia de avacincaptad pegol intravítreo en atrofia geográfica. Ponencia presentada en el Día de la Subespecialidad de Retina de la Academia Americana de Oftalmología; Chicago, IL; 30 de septiembre de 2022.
AXT107 (AsclepiX Therapeutics)
AsclepiX completó el año pasado un pequeño ensayo de fase I/IIa para Edema Macular Diabético (EMD) (n=6, NCT04697758), pero no ha comunicado ningún resultado. El objetivo del AXT107 es inhibir los factores de crecimiento endotelial vascular A y C y activar también la vía Tie2. El número de participantes no alcanzó el objetivo de 18 fijado anteriormente. Al cierre de esta edición, la empresa no había respondido a la solicitud de más información.
CLS-AX (Clearside Biomedical)
CLS-AX, una suspensión inyectable del inhibidor de la tirosina cinasa (ITC) axitinib se administra por vía supracoroidea a través de la plataforma de microinyectores SCS de Clearside. Clearside comunicó recientemente lo que caracterizó como resultados positivos del estudio de extensión OASIS de fase I/IIa (n=19, NCT05131646) en nDMAE.
En el estudio de extensión, el 67% de los participantes pasaron al menos seis meses sin necesitar tratamientos adicionales. También experimentaron una reducción de entre el 77 y el 85 por ciento de la carga de tratamiento durante seis meses.
El propio estudio OASIS de fase I/IIa (n=27, NCT04626128) demostró que los signos observables del posible efecto biológico de axitinib supracoroidal incluían una media estable de la AVMC y una media estable del grosor del subcampo central, que el estudio de extensión confirmó.
Conbercept (Chengdu Kanghong Biotechnology)
Los planes de Chengdu Kanghong el año pasado para obtener la aprobación de la FDA para la proteína de fusión anti-VEGF conbercept fracasaron. Disponible en China desde 2013, el conbercept se dirige al VEGF-A y -B junto con el factor de crecimiento placentario. A principios de este año se presentaron los resultados de dos ensayos de fase III para nDMAE, PANDA-1 y PANDA-2 (NCT03577899; NCT03630952), cada uno con 1.157 pacientes. Ahora figuran como terminados. El año pasado se publicaron pequeños estudios independientes en RVO.1,2 Múltiples estudios en China están evaluando el conbercept para la vasculopatía coroidea polipoidea, el retinoblastoma y otras indicaciones oftálmicas.
EYP-1901 (EyePoint Pharmaceuticals)
EYP-1901 es un inserto bioerosionable de liberación sostenida que utiliza la plataforma Durasert con el TKI vorolanib. El año pasado se inició la inscripción en el ensayo de fase II DAVIO 2 (Durasert y vorolanib en oftalmología 2) en nDMAE (n=150, NCT05381948). Se espera disponer de datos de primera línea en el cuarto trimestre de este año y se prevé que en el ensayo participen pacientes tratados previamente con terapia anti-VEGF.
También se inició el reclutamiento en el ensayo de fase II PAVIA para pacientes con RDNP: retinopatía diabética no proliferativa (n=105, NCT05383209). La finalización está prevista para 2025.
GB-102 (Graybug Vision)
Graybug finalizó el desarrollo de esta plataforma (GB-102) bioerosionable de liberación sostenida que utiliza el TKI sunitinib. Graybug firmó un acuerdo de fusión con CalciMedica con el fin de centrarse en el desarrollo de un fármaco para el tratamiento de la pancreatitis aguda.
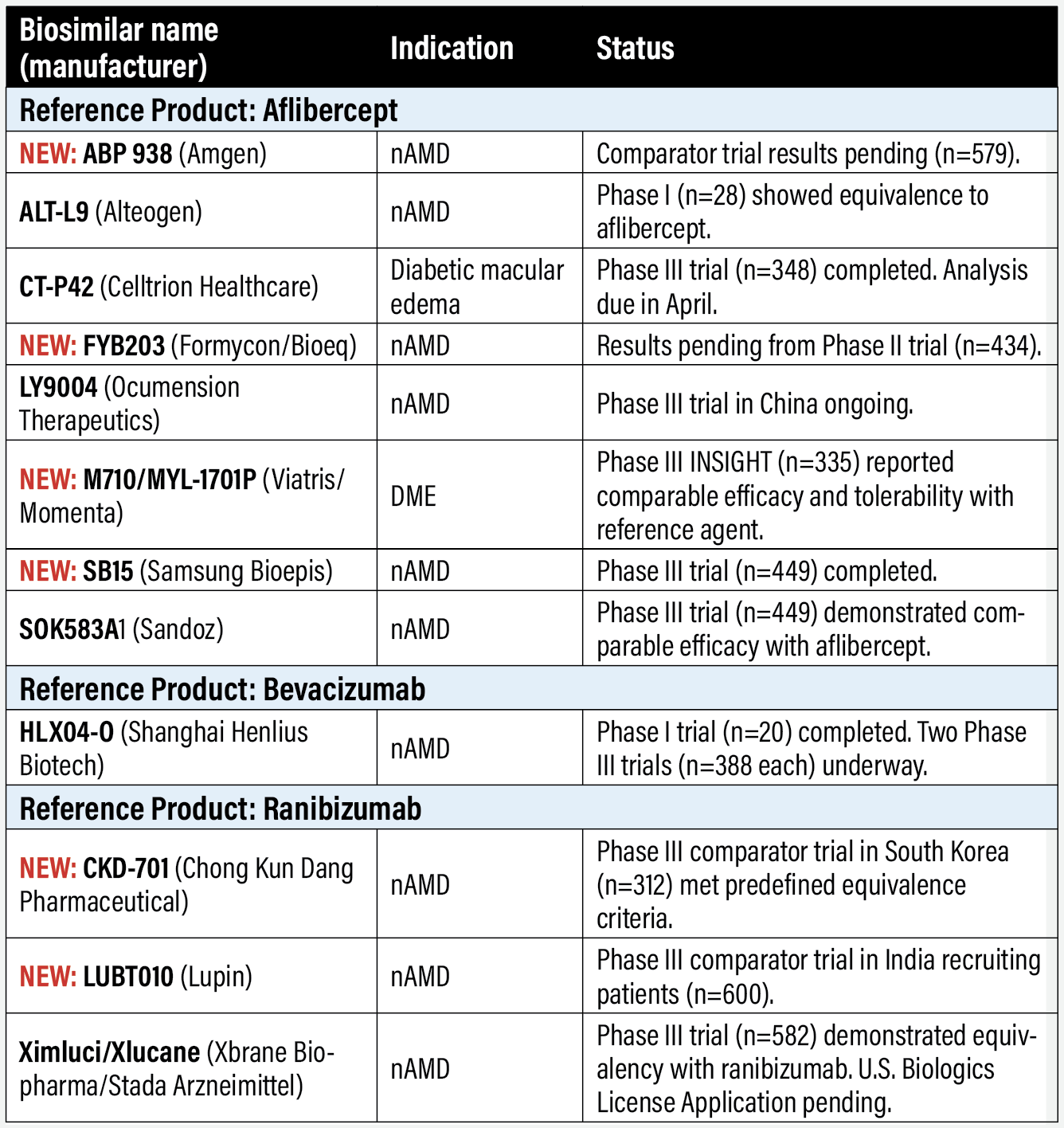
Biosimilares de aflibercept
NUEVO: ABP 938 (Amgen)
Están pendientes los resultados de un ensayo comparativo con aflibercept en la degeneración macular neovascular asociada a la edad (n=579, NCT04270747). El resultado primario es el cambio en la agudeza visual mejor corregida a las ocho semanas. Amgen informó en noviembre de 2022 de que se esperaban datos para finales de año, pero hasta el cierre de esta edición no se había comunicado ninguno.
ALT-L9 (Alteogen) Alteogen, con sede en Corea del Sur, informó en enero que completó un ensayo de fase I en su país de origen de ALT-L9 para nDMAE. ALT-L9 mostró una seguridad y eficacia similares a las del producto de referencia. Los resultados contribuirán al diseño de un ensayo de fase III. En 2021, Alteogen completó un ensayo comparativo de fase I anterior (n=28, NCT-04058535) que mostró una eficacia equivalente en la nDMAE.
CT-P42 (Celltrion)
Celltrion concluyó la inscripción en un ensayo de fase III sobre edema macular diabético (n=348, NCT04739306). La finalización del análisis está prevista para abril.
NUEVO: FYB203 (Formycon/Bioeq) El reclutamiento en el ensayo de fase III MAGELLAN-AMD para nDMAE finalizó el año pasado con resultados pendientes (n=434, NCT04522167). El resultado primario es el cambio en la AVMC a las ocho semanas. Está pendiente la venta de los derechos estadounidenses a Coherus BioSciences.
LY9004 (Ocumension Therapeutics/Shandong Boan Biological Technology)
Boan Biological, filial biotecnológica de Luye Pharma, concedió la licencia de LY09004, también conocido como OT-702, a Ocumension, con sede en China. El activo se encuentra en ensayos de fase III para la nDMAE en China, pero no en Estados Unidos. Boan posee los derechos de licencia fuera de China.
NOVEDAD: M710/MYL-1701P (Viatris/Momenta)
Los resultados a un año del ensayo en personas con EMD central (n=355, NCT03610646) demostraron la equivalencia terapéutica con el producto de referencia.1 En los brazos de MYL-1701P frente a Eylea, la proporción de ojos que ganaron ≥15 y ≥10 letras fue del 32,4 frente al 29,3 por ciento y del 57,4 frente al 58 por ciento, respectivamente. Las proporciones de pérdidas de ≥5 y ≥10 letras fueron del 3,4 frente al 4 por ciento y del 1,7 frente al 1,7 por ciento. Están pendientes los resultados de un estudio de extensión que evalúa la seguridad y la eficacia (n=52, NCT04674800).
NUEVO: SB15 (Samsung Bioepis)
El año pasado finalizó un ensayo comparativo de fase III con aflibercept para la nDMAE (n=449, NCT04450329). Cumplió el criterio de valoración primario: cambio comparable respecto al valor basal en la AVMC en la semana 8. Un análisis provisional a las 32 semanas también demostró la comparabilidad de otros criterios secundarios de valoración de la eficacia, la seguridad, la inmunogenicidad y la farmacocinética.
SOK583A1 (Sandoz)
Sandoz, una división de Novartis, cerró la inscripción de pacientes en el ensayo de fase III MYLIGHT (n=85, NCT04864834) para nDMAE comparando SOK583A1 con el producto de referencia. En el ensayo se evalúan los cambios en la AVMC al cabo de 52 semanas.
Biosimilar de bevacizumab
HLX04-O (Shanghai Henlius Biotech)
SHB está reclutando pacientes en dos estudios de fase III para la nDMAE: uno en Australia (n=388, NCT04740671) y otro en China (n=388, NCT05003245), con fechas de finalización en junio de este año y marzo de 2024, respectivamente. Un ensayo de fase I sobre seguridad y eficacia realizado en China informó de que HLX04-O fue bien tolerado (n=20, NCT04993352).3 El biosimilar ya está aprobado en China para indicaciones oncológicas.
Biosimilares de ranibizumab
NUEVO: CKD-701 (Chong Kun Dang Pharmaceutical)
Un ensayo clínico de fase III en pacientes con nDMAE con ranibizumab como comparador ha revelado que el biosimilar cumple los criterios de equivalencia predefinidos (n=312, NCT04857177).4 El ensayo se llevó a cabo en Corea del Sur, donde se encuentra la empresa patrocinadora. Chong Kun Dang tiene numerosas afiliaciones con empresas estadounidenses, entre ellas Pfizer y Amgen.
NUEVO: LUBT010 (Lupin)
Un ensayo comparativo de fase III con el producto de referencia para la nDMAE está reclutando pacientes en la India (n=600, NCT04690556). El criterio de valoración principal es el cambio en la AVMC a los 12 meses. Lupin ha recibido la aprobación de la FDA para una serie de medicamentos genéricos y tiene dos biosimilares oncológicos: uno para Filgrastim, para el que ha solicitado la aprobación de la FDA, y otro para Etanercept, aprobado en la India, Japón y la Unión Europea.
Ximluci/Xlucane (Xbrane Biopharma/Stada Arzneimittel)
La Comisión Europea autorizó el pasado otoño la comercialización de Xlucane, y el Reino Unido hizo lo propio en enero. El lanzamiento en ambos mercados está previsto para principios de este año. En Estados Unidos, Xbrane y Stada retiraron la solicitud de licencia biológica que habían presentado a la FDA, aplazando ese trámite reglamentario al primer trimestre de este año. Los patrocinadores concluyeron la primavera pasada un ensayo de fase III (n=582, NCT03805100), que demostró la equivalencia con el producto de referencia. Bausch + Lomb tiene un acuerdo con Xbrane y Stada para comercializar Ximluci en Estados Unidos y Canadá.
REFERENCIAS
1. Bressler SB, Barve A, Beckmann K, et al. MYL-1701P (aflibercept biosimilar propuesto) comparado con Eyelea en EMD: Resultados del estudio de fase 3 INSIGHT. Póster PO387. Presentado en la Academia Americana de Oftalmología.
2. Woo SJ, Saddam SRm Bradvica M, et al. Una propuesta de biosimilar a aflibercept en la degeneración macular neovascular asociada a la edad (nDMAE): resultados de 31 semanas. Póster PO381. Presentado en la Academia Americana de Oftalmología.
3. Eficacia y seguridad de HLX04-O intravítreo, un anticuerpo monoclonal anti-VEGF, para el tratamiento de la degeneración macular húmeda asociada a la edad. Int J Ophthalmol. 2022;15:1549-1553.
4. Yoon CK, Oh J, Bae K, Park UC, Yu KS, Yu HG. Eficacia y seguridad de un nuevo biosimilar de ranibizumab CKD-701 utilizando un régimen de tratamiento pro re nata en la degeneración macular neovascular relacionada con la edad: A Phase 3 randomized clinical trial. PLoS One. 2022;17:e0275611. doi: 10.1371/journal.pone.0275611.
NUEVO: IBE-814 (Ripple Therapeutics)
Se trata de un implante intravítreo bioerosionable que, según Ripple Therapeutics, libera una décima parte de la carga farmacológica del corticosteroide dexametasona. El otoño pasado se inició un ensayo de fase II en OVR y EMD (n=50, NCT04576689). La empresa informa que, hasta ahora, los ensayos no han mostrado el aumento de la inflamación intraocular que se produce con otros corticosteroides en el ojo.
IBI302 (Innovent Biologics)
IBI302 (efdamrofusp alfa) es un anticuerpo intravítreo biespecífico que actúa tanto sobre el VEGF como sobre las vías C3b/C4b. Los resultados preliminares del ensayo de fase I de escalado de dosis en nDMAE (n=36, NCT03814291) mostraron que era bien tolerado.3
Los estudios preclínicos demostraron que la proteína de fusión biespecífica tenía una eficacia superior a la monoterapia con anti-VEGF. Se observó que la acción de inhibición dual inhibía aún más la infiltración de macrófagos y la polarización de macrófagos M. 2.3
ISTH0036 (Isarna Therapeutics)
ISTH0036 se dirige al factor de crecimiento transformante beta (por sus siglas en inglés TGF-β, abreviatura de transforming growth factor beta). Isarna inició la inscripción en 2021 en BETTER, un ensayo de fase IIa que evalúa esta terapia antisentido para nDMAE y DME (el ensayo no aparece en ClinicalTrials.gov). Los resultados de los 18 pacientes tratados hasta ahora han demostrado un perfil de seguridad aceptable hasta los 12 meses, sin efectos adversos relacionados con el fármaco ni signos de inflamación ocular.4
El objetivo del estudio, que se está llevando a cabo en Austria y la India, es reclutar hasta 30 pacientes para cada indicación. El criterio de valoración principal es la reducción del líquido retiniano y del grosor macular central, y la mejora de la visión global como criterio de valoración secundario. El ensayo pretende explorar la prevención de la fibrosis y la transición epitelio-mesénquima (en inglés EMT) como factor diferenciador clave frente a las terapias anti-VEGF.
OCS-01 (Oculis)
OCS-01 es una formulación tópica de dexametasona de alta concentración y sin conservantes. El ensayo de fase III DIAMOND (n=482, NCT05066997) en EMD aparece como reclutamiento, pero no se han publicado actualizaciones desde 2021. La finalización del ensayo está prevista para 2024.
ONS-5010/Lytenava (bevacizumab-vikg, Outlook Therapeutics)
ONS-5010 es una formulación oftálmica de Avastin. Outlook cumplió su palabra de presentar ante la FDA una solicitud de licencia biológica (BLA) para ONS-0510, que la agencia aceptó el pasado otoño. La FDA fijó el 29 de agosto de este año como fecha límite para tomar medidas en virtud de la Ley de tarifas a los usuarios de medicamentos de venta con receta (PDUFA). La solicitud se basó en los resultados del ensayo de fase III NORSE TWO (n=228, NCT03834753) en nDMAE, que mostraron la no inferioridad frente a ranibizumab.
NUEVO: OPL-0401 (Valo Health)
Valo Health inició un estudio multicéntrico de fase II para evaluar la seguridad y eficacia de OPL-0401 oral en pacientes con Retinopatia dibetica no proliferativa leve, moderada y grave (n=120, NCT05393284). OPL-0401 es un inhibidor de la rho-quinasa 1/2 de molécula pequeña. La finalización del ensayo está prevista para 2024.
OPT-302 (Opthea)
Dos ensayos de fase III para la nDMAE están en curso: ShORe (n=990, NCT04757610) y COAST (n=990, NCT04757636). En ellos se está evaluando OPT-302 intravítreo de 2 mg en combinación con 0,5 mg de ranibizumab o 2 mg de aflibercept, respectivamente. La finalización del estudio está prevista para finales del próximo año. Opthea afirma que espera presentar los resultados de las 52 semanas a finales de año.
Los datos de fase IIb de OPT-302 en combinación con ranibizumab para la vasculopatía coroidea polipoidea demostraron un perfil de seguridad compatible con la monoterapia anti-VEGF-A de tratamiento estándar 5.
El estudio también demostró una mayor mejoría de la AVMC y una menor cantidad de líquido retiniano en los pacientes tratados con OPT-302 que en los tratados con ranibizumab en monoterapia en la semana 24.
NUEVO: OTT166 (OcuTerra Therapeutics)
Se ha iniciado el registro de pacientes en el ensayo de fase II DR:EAM (acrónimo de Diabetic Retinopathy: Early Active Management) que evalúa OTT166 en adultos con NPDR de moderadamente grave a grave o PDR leve con pérdida mínima de visión (n=210, NCT05409235). OTT166 es un colirio inhibidor selectivo de la integrina de molécula pequeña. OTT166 está diseñado para ser utilizado como colirio por el paciente en su domicilio antes de que la RD avance a una fase que ponga en peligro la visión.
OTX-TKI (Ocular Therapeutix)
Los datos provisionales a diez meses del ensayo de fase I (n=21, NCT04989699) de este implante intravítreo de axitinib para la nDMAE se esperan para febrero. Los datos provisionales a siete meses mostraron que el 73% de los pacientes tratados no necesitaron tratamiento de rescate y obtuvieron resultados en cuanto a cambios en la AVMC y en el grosor del subcampo central comparables a los del brazo de aflibercept.6 La empresa también afirma haber iniciado un ensayo de fase I en RD, pero no se ha registrado en ClinicalTrials.gov.
PAN-90806 (PanOptica)
Esta formulación tópica es un inhibidor selectivo del receptor 2 del VEGF. El ensayo de fase I/II en nDMAE ha finalizado (n=51, NCT03479372), pero no se han publicado actualizaciones. PanOptica no respondió a una consulta al cierre de esta edición.
RBM-007 (Ribomic)
Dos estudios de fase II en los que se evaluó RBM-007, un aptámero contra el factor 2 de crecimiento fibroblástico, para la nDMAE no han mostrado beneficios ni de la monoterapia ni del tratamiento combinado con aflibercept en pacientes tratados previamente (TOFU, n=86, NCT04200248; y RAMEN, n=22, NCT04640272).
Sin embargo, Ribomic afirma que los datos del estudio TEMPURA IST (n=5, NCT04895293), mucho más pequeño, demostraron lo que caracterizó como «una tendencia positiva» de mejora de la AVMC y del grosor del subcampo central. Según los informes, la mayoría de los participantes en el estudio también mostraron mejoras en los dos criterios de valoración.
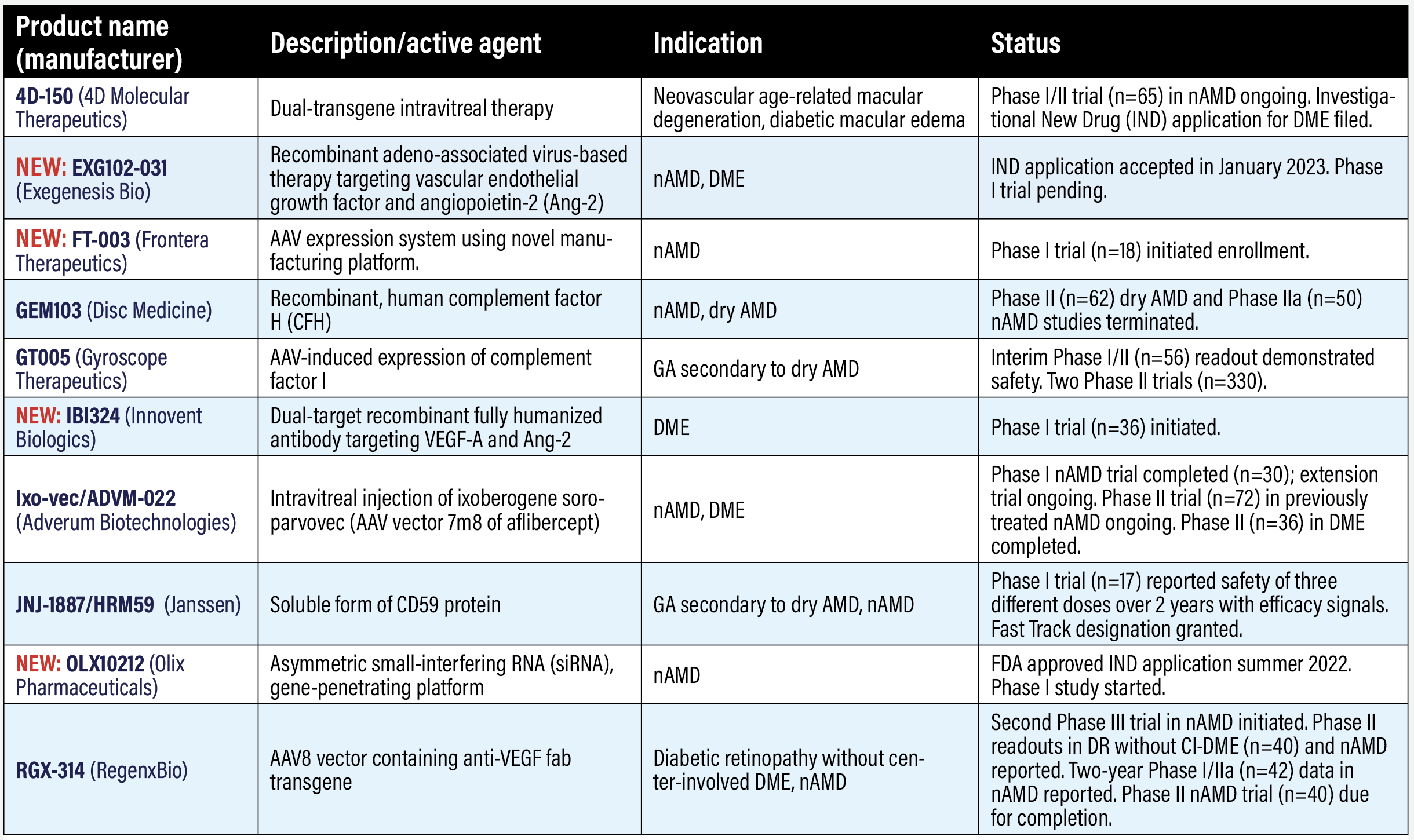
4D-150 (4D Molecular Therapeutics)
4D-150 consiste en el vector intravítreo dirigido y evolucionado, R100, y una carga útil que expresa aflibercept y un ARN de interferencia del factor de crecimiento endotelial vascular-C. La carga útil transgénica dual inhibe el VEGF-A, B, C y el factor de crecimiento placentario. En 2021 se inició un ensayo de fase I/II en degeneración macular neovascular asociada a la edad (n=65, NCT05197270). Los datos clínicos provisionales de la primera cohorte (n=5) demostraron que el tratamiento era seguro y bien tolerado. Un subgrupo de tres pacientes presentó expresión mediada de la proteína transgénica aflibercept en el humor acuoso 12 semanas después de la inyección. Las tasas anualizadas de inyección de anti-VEGF de los pacientes de la cohorte se redujeron en un 96,7 por ciento. Está previsto que el estudio finalice en 2026. 4DMT también presentó una solicitud de nuevo fármaco en fase de investigación (IND) para un ensayo en edema macular diabético, que la empresa afirma que espera iniciar a finales de 2023.
NUEVO: EXG102-031 (Exegenesis Bio)
La Food and Drug Administration (FDA) ha autorizado la solicitud de IND para EXG102-031, una terapia génica recombinante basada en el virus adenoasociado (AAV) administrada mediante inyección intraocular cuyo objetivo es expresar una proteína de fusión terapéutica que se une o neutraliza todos los subtipos conocidos de VEGF y angiopoyetina-2 (Ang-2).
NUEVO: FT-003 (Frontera Therapeutics)
Frontera acaba de administrar la dosis al primer paciente de un ensayo de fase I para la nDMAE en China (n=18, NCT05611424). Frontera describe FT-003 como un sistema de expresión génica AAV que utiliza su plataforma de fabricación patentada APEX.
GEM103 (Disc Medicine)
Gemini Therapeutics, adquirida el año pasado por Disc Medicine, desarrolló GEM103, una proteína humana recombinante del factor H del complemento (CFH), pero terminó los estudios de fase II tanto en la DMAE neovascular (n=50, NCT04684394) como en la DMAE seca (n=62, NCT04643886). Ambos estudios demostraron que el tratamiento era bien tolerado. El ensayo sobre la DMAE seca demostró que GEM103 podía reducir los biomarcadores de activación del complemento manteniendo niveles suprafisiológicos de CFH.
GT005 (Gyroscope Therapeutics/Novartis)
GT005 tiene como objetivo inducir la expresión del factor I del complemento. Los datos provisionales del ensayo de fase I/II FOCUS en atrofia geográfica (n=56, NCT03846193) mostraron que el tratamiento fue bien tolerado.2 FOCUS evaluó dos métodos de administración: inyección subretiniana transvítrea y con el sistema de administración subretiniana Orbit (SDS). De los ocho pacientes que recibieron el tratamiento con SDS, seis presentaron 20 acontecimientos adversos oculares, todos ellos considerados leves y no relacionados con el tratamiento. Están en marcha otros tres ensayos de GT005 en la nDMAE: ORACLE, un seguimiento a largo plazo que evalúa la seguridad y la durabilidad (n=200, NCT05481827), cuya finalización está prevista para 2028; EXPLORE, un ensayo de fase II de dos dosis en AG (n=75, NCT04437368), cuya finalización está prevista para 2025; y HORIZON, un ensayo de fase II del tratamiento con dosis medias y altas en AG (n=255, NCT04566445), cuya finalización está prevista para 2025. Novartis adquirió Gyroscope el año pasado.
NUEVO: IBI324 (Innovent Biologics)
Innovent describe IBI324 como un anticuerpo intravítreo totalmente humanizado, de doble diana específica, dirigido contra VEGF-A y Ang-2. Se dosificó al primer paciente en el ensayo de fase I en EMD (n=21, NCT05489718).
Ixo-vec/ADVM-022 (Adverum Biotechnologies)
Adverum comunicó los resultados de dos años del ensayo OPTIC de fase I en nDMAE de lo que ahora denomina Ixo-vec -soroparvovec ixoberogénico– (n=30, NCT03748784).1 El ensayo evaluó dos dosis diferentes: una de 2 x 1011 genes vectoriales por ojo (vg/ojo) y una dosis inferior de 6 x 1011 vg/ojo. Ixo-vec pareció ser bien tolerado y la inflamación dependiente de la dosis respondió a los esteroides. Todos los pacientes con dosis más elevadas estaban libres de inflamación y de tratamiento con esteroides al finalizar el estudio. Las inyecciones anuales de anti-VEGF disminuyeron entre un 81 y un 98% y los niveles de proteína de aflibercept se mantuvieron durante tres años en el estudio de extensión.
El 53% y el 80% de los grupos de dosis 2E11 y 6E11, respectivamente, estuvieron libres de inyecciones suplementarias durante dos años. Los 30 participantes de OPTIC están inscritos en el ensayo de extensión de OPTIC (NCT04645212), cuya finalización está prevista para junio de 2025. El primer paciente recibió la dosis en el ensayo de fase II LUNA (n=72, NCT05536973), que evalúa ambas dosis en pacientes con nDMAE previamente tratados. La finalización está prevista para este año. Adverum también registró un ensayo de fase II para ambas dosis en EMD (n=36, NCT04418427), que finalizó en diciembre de 2022. Los resultados están pendientes.
JNJ-1887/HRM59 (Janssen Pharmaceuticals)
JNJ-1887 es un tratamiento intravítreo cuyo objetivo es aumentar la expresión de una forma soluble de CD59 (sCD59) para proteger las células de la retina. Desarrollado originalmente por Hemera Biosciences, Janssen, una empresa de Johnson & Johnson, adquirió el año pasado los derechos de lo que se conocía como HMR59 (también se llama JNJ-81201887 y antes AAVCAGsCD59). En un estudio de fase I de escalada de dosis de una única inyección intravítrea (n=17, NCT03144999) se informó de que los pacientes fueron tratados a tres dosis escalonadas sin profilaxis con esteroides, cumpliendo su criterio de valoración primario de seguridad y tolerabilidad, lo que justifica nuevas investigaciones.3 La FDA concedió a JNJ-1887 la designación de Fast Track.
NUEVO: OLX10212 (Olix Pharmaceuticals)
La FDA aprobó una solicitud IND para este agente que utiliza un ARN asimétrico de interferencia pequeña (siRNA), tecnología de penetración de genes para dirigirse a los orígenes genéticos de la inflamación. El ensayo de fase I (n=60, NCT05643118) comenzó a reclutar pacientes en diciembre de 2022.
RGX-314 (RegenxBio)
Este vector AAV-8 contiene un transgén anti-VEGF administrado por vía supracoroidea. Los primeros resultados del ensayo AAVIATE de fase II en nDMAE (n=115, NCT04514653) mostraron que 85 pacientes de las cinco primeras cohortes toleraron bien la administración supracoroidea.4 Los pacientes de los brazos de RGX-314 recibieron dosis de 2,5 x 1011 o 5 x 1011 copias genómicas por ojo (gc/ojo). A los seis meses, seguían presentando una AVMC y un grosor de la retina central estables, al igual que el grupo de control de ranibizumab. Más del 70% de los pacientes necesitaron menos inyecciones de anti-VEGF después del tratamiento. Diez de los 15 pacientes del tercer nivel de dosis, es decir, el 67%, no necesitaron inyecciones de anti-VEGF durante los seis meses posteriores a la administración. RegenxBio afirma que se espera que los ensayos de fase II/III ATMOSPHERE (n=300, NCT04704921) y ASCENT (n=465, NCT05407636), cuya finalización está prevista para 2023, respalden una solicitud de licencia biológica (BLA) para nDMAE a la FDA el año próximo.
RegenxBio también está llevando a cabo el ensayo de fase II ALTITUDE para EMD con afectación central utilizando la plataforma de administración supracoroidal (n=100, NCT04567550). Los resultados provisionales de las tres primeras cohortes (n=50) mostraron que el 20 por ciento presentaba una mejora de más de dos escalones en la Escala clínica internacional de gravedad de la retinopatía diabética frente al 10 por ciento de los controles y el 54 por ciento presentaba alguna mejora en la Escala clínica internacional de gravedad de la retinopatía diabética frente al 20 por ciento de los controles.5 Los pacientes de la cohorte 1 recibieron una dosis de 1,5 x 1011 gc/ojo, que se aumentó a 5 x 1011 gc/ojo en las cohortes 2 y 3. Ninguno necesitó corticosteroides profilácticos antes o después del tratamiento. El ensayo se está ampliando para incluir una dosis mayor de 1 x 1012 gc/ojo.
REFERENCIAS
1. Regillo C. ADVM-022 intravitreal gene therapy for neovascular age-related macular degeneration: End of study results from the 2-year OPTIC trial. Paper presented at the 55th annual Scientific Meeting of the Retina Society; Pasadena, CA; November 4, 2022.
2. Eichenbaum D. Preliminary results from a first-in-human Phase I/II gene therapy trial (FOCUS) of GT005, an investigational AAV2 vector, delivered using the Orbit subretinal system in patients with geography atrophy secondary to age-related macular degeneration. Paper presented at the 55th annual Scientific Meeting of the Retina Society; Pasadena, CA; November 4, 2022.
3. Cohen MN. Phase I study of JNJ-81201877 gene therapy in geographic atrophy (GA) due to age-related macular degeneration (AMD). Paper presented at American Academy of Ophthalmology Retina Subspecialty Day; Chicago, IL; September 30, 2022.
4. Campochiaro PA. Gene therapy for neovascular AMD. Paper presented at American Academy of Ophthalmology Retina Subspecialty Day; Chicago, IL; October 1, 2022.
5. Vajzovic L. Suprachoroidal delivery of RGX-314 for diabetic retinopathy: The Phase II ALTITUDE study. Paper presented at the 55th annual Scientific Meeting of the Retina Society; Pasadena, CA; November 2, 2022..
Risuteganib (Luminate, Allegro Ophthalmics)
Allegro dice que está preparando un ensayo clínico de fase IIb/III en pacientes con DMAE seca intermedia. Allegro no ha publicado una actualización de los resultados del ensayo de fase IIa de risuteganib en la DMAE intermedia desde 2021 (n=40, NCT03626636). Dos estudios exploraron cómo risuteganib puede proteger las células del epitelio pigmentario de la retina.7,8 Risuteganib es un péptido pequeño estabilizador del estrés oxidativo.
RO7250284 (Genentech/Roche)
El ensayo de fase I para la nDMAE, ahora conocido como BURGUNDY, sigue reclutando pacientes y el número de participantes ha aumentado de 50 a 251 (NCT04567303). El RO7250284 es una forma Fab humana biespecífica de faricimab administrada a través del implante de liberación por puerto utilizado con Susvimo, el implante de liberación por puerto con ranibizumab. La finalización del estudio está prevista para 2027.
Tarcocimab tedromer/KSI-301 (Kodiak Sciences)
Este conjugado biopolimérico anti-VEGF es objeto de ensayos en cuatro indicaciones. El ensayo BEACON de fase III en la OVR (n=568, NCT04592419) alcanzó su objetivo primario de no inferioridad frente a aflibercept en cuanto al cambio de la AVMC a las 24 semanas.
Kodiak también comunicó que se había completado la inscripción en el ensayo de fase III GLOW de dosificación semestral en pacientes con NPDR de moderadamente grave a grave sin EMD que no habían recibido tratamiento (n=253, NCT05066230).
La empresa también comunicó lo que calificó de resultados decepcionantes del ensayo de fase IIb/III DAZZLE de dosificación flexible en nDMAE (n=558, NCT04049266). Los datos iniciales mostraron que tarcocimab no alcanzó el criterio de valoración principal de no inferioridad frente a aflibercept.
El ensayo de fase III DAYLIGHT evalúa el tarcocimab mensual en la nDMAE (n=557, NCT04964089). GLEAM (n=460, NCT04611152) y GLIMMER (n=459, NCT04603937) evalúan tarcocimab en EMD.
THR-149, THR-687 (Oxurion)
Un comité independiente de supervisión de datos aconsejó el año pasado continuar con el ensayo de fase IIb KALAHARI en EMD (n=126, NCT04527107). El ensayo compara el inhibidor de la calicreína plasmática THR-149 y el aflibercept en pacientes que no responden al tratamiento anti-VEGF. Está previsto que el ensayo concluya a finales de año, pero Oxurion afirma que espera presentar datos de primera línea en el segundo semestre.
El THR-687 es un antagonista de la Arginina-glicina-ácido aspártico (también conocido como secuencia RGD por sus siglas en inglés). Los datos de optimización de dosis de la Parte A del ensayo de fase II INTEGRAL en EMD (n=16, NCT05063734) no alcanzaron los criterios de valoración clave de mejora de la AVMC y el CST. Oxurion, que en un principio tenía previsto inscribir a 303 pacientes, puso fin al ensayo basándose en los resultados obtenidos en 16 pacientes.
UBX1325 (UNITY Biotechnology)
Unity persigue dos indicaciones para UBX1325: EMD y nDMAE. Unity describe UBX1325 como un potente inhibidor de moléculas pequeñas del linfoma de células B extragrandes (Bcl-xL) cuyo objetivo es inhibir la función de las proteínas de las que dependen las células senescentes para sobrevivir.
El ensayo BEHOLD de fase II de prueba de concepto en EMD (n=65, NCT04857996) cumplió sus criterios de seguridad y eficacia a las 24 semanas, incluido el cambio medio en la AVMC. La empresa afirma que espera obtener datos de seguridad y eficacia del ensayo a las 48 semanas en el segundo trimestre. Tiene previsto iniciar un estudio pivotal en EMD en el segundo semestre de 2023.
En nDMAE, el ensayo ENVISION de fase II completó la inscripción (n=46, NCT05275205). Los pacientes son aleatorizados para recibir dos dosis de UBX1325 (10 mcg) en la primera y cuarta semanas o aflibercept (2 mg) cada ocho semanas. La empresa espera obtener los resultados de seguridad y eficacia de ENVISION a las 16 semanas en el segundo trimestre de este año.
Xiflam (InflammX)
Xiflam es un inhibidor oral del inflamasoma NLRP3 de molécula pequeña que se dirige a la proteína Connexin43 y bloquea la formación de hemicanales. El pasado otoño, InflammX presentó una modificación de medicamento nuevo en investigación que, según dijo entonces, permitiría a la Red de Retina del DRCR iniciar un ensayo de fase IIb en EMD y RD.
InflammX afirma que el ensayo también evaluará el efecto terapéutico de Xiflam sobre los biomarcadores de la enfermedad renal activa. Sin embargo, no se ha registrado ningún ensayo en ClinicalTrials.gov.
Xipere (Clearside Biomedical)
Antes conocido como CLS-TA, Xipere, la suspensión supracoroidal de acetónido de triamcinolona, ya aprobada por la FDA para el edema macular uveítico, fue objeto del ensayo TYBEE de fase II para el EMD (n=71, NCT03126786), finalizado hace tiempo. Ya no figura en la lista de Clearside en su sitio web, pero su socio Arctic Vision persigue la indicación del EMD para una iteración renombrada conocida como Arcatus/ARVN001 en Australia, Nueva Zelanda y Asia. Ambas empresas tienen activo un ensayo de fase I de EMD en esos países.
REFERENCIAS
1. Bai JY, Wang WY, Dou ZZ, Geng BC, Xu XY, Zhu YZ, Zhao SY, Liu M, Jia SY, Luo WJ. Efficacy of intravitreal conbercept injection on short- and long-term macular edema in branch retinal vein occlusion. Int J Ophthalmol. 2022 18;15:489-494.
2. Zhao T, Chen Y, Zhang HS, Chen Y, Wang ZJ. Efficacy of conbercept after switching from bevacizumab/ranibizumab in eyes of macular edema secondary to central retinal vein occlusion. Int J Ophthalmol. 2022 18;15:609-614.
3. Yang S, Li T, Jia H, et al. Targeting C3b/C4b and VEGF with a bispecific fusion protein optimized for neovascular age-related macular degeneration therapy. Sci Transl Med. 2022;14:eabj2177. doi: 10.1126/scitranslmed.abj2177.
4. Munk M, Bolz M, Strauss, et al. Long-term safety and efficacy of ISTH0036, a selective TGF-B2 blocking antisense in preclinical and clinical studies. FP-1050 presented at EURETINA 22; Hamburg, Germany; September 4, 2022.
5. Cheung G. OPT-302 Combination Therapy with Ranibizumab for Treatment of Polypoidal Choroidal Vasculopathy. Paper presented at Bascom Palmer 19th annual Angiogenesis, Exudation, and Degeneration 2022; virtual; February 12, 2022.
6. Dhoot DS. Interim safety and efficacy data from a Phase I clinical trial of sustained-release axitinib hydrogel implant (OTX-TKI) in wet AMD subjects. Paper presented at American Academy of Ophthalmology Retina Subspecialty Day; Chicago, IL; September 30, 2022.
7. Yang P, Trimpey-Warhaftig R, Koo JM, et al. Cellular uptake of risuteganib via endocytosis in cultured human RPE cells. Invest Ophthalmol Vis Sci. 2022;63:3041.
8. Koo JM, Call C, Zhou D, et al. Risuteganib-directed staining localizes in the retinal pigment epithelium of retinal tissue from aged, but not young mice. Invest Ophthalmol Vis Sci. 2022;63:4414.
Terapias en fase de investigación para enfermedades hereditarias de la retina
4D-125 (Molecular Therapeutics)
La FDA concedió la designación de vía rápida al 4D-125, dirigido a las distrofias hereditarias de la retina debidas a defectos en el gen RPGR, incluida la retinosis pigmentaria ligada al cromosoma X (XLRP). El 4D-125 está diseñado para administrar una copia funcional del gen regulador de la GTPasa de la retinosis pigmentaria (RPGR) a los fotorreceptores de la retina. 4DMT completó la inscripción en el ensayo clínico abierto de fase I/II para evaluar la seguridad de la dosis máxima tolerada (n=43, NCT04517149). Los criterios de valoración secundarios incluyen evaluaciones de la función visual y criterios de valoración anatómicos.
Molecular Therapeutics prevé dar actualizaciones adicionales en 2024. La finalización del ensayo está prevista para 2029.
AGTC-402, rAAV2tYF-PR.7-hCNGB3, AGTC-501 (Applied Genetic Technologies Corp.)
AGTC está llevando a cabo programas para la XLRP y la acromatopsia. En la acromatopsia, un ensayo de fase I/II está evaluando el vector rAAV2tYF-PR.7-hCNGB3, dirigido al gen CNGB3 (n=32, NTC02599922). Un programa previo para el tratamiento de la acromatopsia en el que se evaluaba el AGTC-402 para mutaciones en el gen CNGA3 se descartó a la vista de los resultados de la fase I/II (NCT02935517).
En XLRP, se comunicaron datos provisionales positivos de tres meses del ensayo de fase II SKYLINE con AGTC-501 (n=42, NCT03316560), un tratamiento basado en un vector viral recombinante adenoasociado (AAV) dirigido a las mutaciones del gen RPGR. La empresa afirma que el ensayo demostró mejoras sólidas de la sensibilidad visual, el criterio principal de valoración de la eficacia del ensayo, en múltiples pacientes tres meses después de la administración de la dosis, con una tasa de respuesta del 62,5% en el grupo de dosis B y del 25% en el grupo de dosis A. SKYLINE es una ampliación multicéntrica del estudio de fase I/II en curso que asigna aleatoriamente a los pacientes a una dosis alta o baja de AGTC-501. Está previsto un ensayo de fase II/III para evaluar el vector, pero aún no se ha iniciado el reclutamiento (n=63, NCT04850118). Syncona Ltd. adquirió AGTC el año pasado.
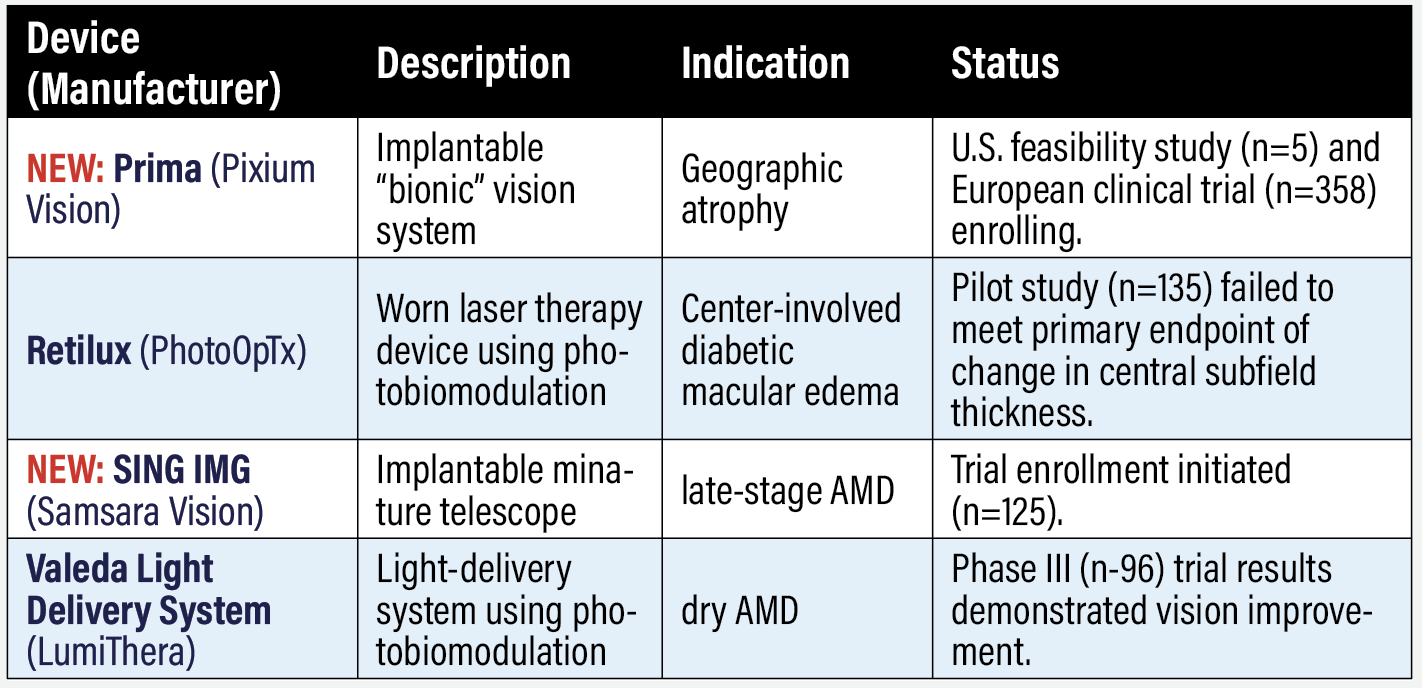
NUEVO: Prima (Pixium Vision)
Este implante intraocular utiliza un sistema «biónico» patentado, como lo denomina Pixium Vision, para restaurar la visión en la atrofia geográfica. En 2022 se inició el estudio PRIMAvera (n=358, NCT04676854), con la implantación del primer implante a un paciente en Italia. La finalización del ensayo está prevista para 2026. Pixium cuenta con un implante de segunda generación que ha demostrado una mejora de la visión en ratas.1 Un estudio de viabilidad estadounidense también está reclutando pacientes (n=5, NCT03392324), con finalización prevista para finales de año.
Retilux (PhotoOpTx)
Este dispositivo, que se lleva como un parche ocular, administra terapia láser directamente al ojo afectado mediante fotobiomodulación (PBM), que utiliza luz en el rango de 630 a 900 nm. El estudio piloto (n=135, NCT03866473) comparó la PBM con un tratamiento con placebo en ojos con edema macular diabético con afectación central y buena visión. Los pacientes de PBM recibieron dos tratamientos diarios de 90 segundos a 670 nm durante cuatro meses. El resultado primario fue el cambio en el grosor del subcampo central a los cuatro meses. Los pacientes del grupo placebo experimentaron una mejoría más acusada: 15 (desviación típica 57) frente a 13 (53) µm, según los resultados publicados en septiembre de 2022 en ClinicalTrials.gov. Al cierre de esta edición, la empresa no había respondido a la solicitud de más información.
NUEVO: SING IMT (Samsara Vision)
Samsara inició la inscripción en el estudio prospectivo CONCERTO de este implante en pacientes con degeneración macular asociada a la edad en fase avanzada (n=125, NCT05438732). SING IMT son las siglas de telescopio implantable en miniatura de nueva generación y menor incisión. Los primeros procedimientos en EE.UU. con el SING IMT se realizaron el verano pasado. La Food and Drug Administration (FDA) aprobó un estudio complementario posterior a la comercialización para evaluar las mejoras en la agudeza visual y la seguridad del dispositivo. CONCERTO está reclutando a las personas mayores con escotomas centrales bilaterales estables debidos a DMAE en fase avanzada y atrofia geográfica con afectación de la fóvea o cicatriz disciforme.
Sistema de administración de luz Valeda (LumiThera)
LumiThera informó de los resultados del ensayo LIGHTSITE III en DMAE seca (n=96, NCT04065490). Los pacientes fueron aleatorizados 2:1 a PBM o placebo. Los resultados del ensayo demostraron una mejora estadísticamente significativa de la agudeza visual mejor corregida a los 13 meses en el grupo de PBM frente al simulado (p = 0,02). El brazo PBM tuvo un aumento sostenido, promedio en el tratamiento precoz de la retinopatía diabética estudio letra puntuación de 5,5 letras desde el inicio a los 13 meses (p <0,0001). El 55% de los pacientes que respondieron al PBM mostraron una mejora >5 letras en la tabla optométrica EDTRS estándar, con una media de 9,7 letras, y el 26% logró una mejora >10 letras, con una media de 12,8 letras.
REFERENCIAS
1. Wang BY, Chen ZC, Bhuckory M, et al. Electronic photoreceptors enable prosthetic visual acuity matching in the natural resolution in rats. Nature Comm. 2022;13:6627.
ALK-001 (Alkeus Pharmaceuticals)
El reclutamiento finalizó en 2021 en un ensayo de fase II/III (n=300, NCT03845582) de esta forma oral modificada de vitamina A, pero aún no se han publicado los resultados del ensayo. Alkeus está llevando a cabo dos ensayos en la enfermedad de Stargardt: el ensayo de fase II TEASE (n=140, NCT02402660), cuya finalización está prevista para 2025; y un estudio de extensión abierto de TEASE al que sólo se puede acceder por invitación (n=140, NCT 04239625). Los ensayos evalúan ALK-001 frente a placebo durante un máximo de 24 meses. ALK-001 también es objeto de otro ensayo en atrofia geográfica. Alkeus no respondió a una solicitud de información actualizada al cierre de esta edición.
ATSN-101/SAR439483 (Atsena Therapeutics)
ATSN-101, antes conocido como SAR439483, es un tratamiento basado en AAV para la amaurosis congénita de Leber causada por mutaciones bialélicas en el gen GUCY2D. Los resultados de un ensayo clínico de fase I/II (n=15, NCT03920007) demostraron que los pacientes toleraban bien la administración subretiniana con la dosis más alta de 1 x 1011 genes vectoriales por ojo (vg/ojo) y presentaban mejoras significativas de la visión.1 La inscripción en el ensayo finalizó en julio de 2022 y la finalización del estudio está prevista para 2027.
Botaretigene sparoparvovec/AAV-RPGR (MeiraGTx Holdings/Janssen Pharmaceutical Cos.)
Anteriormente denominado AAV-RPGR, se trata de un vector AAV recombinante diseñado para administrar copias funcionales del gen RPGR en pacientes con XLRP asociado al gen RPGR. Un resultado del ensayo de fase I/II en curso (n=49, NCT03252847) demostró lo que Janssen describe como un perfil de seguridad aceptable, junto con evaluaciones de eficacia que mostraron mejoras en la sensibilidad retiniana, la función visual y la visión funcional.2
En general, se observaron tres acontecimientos adversos graves. La mayoría estaban relacionados con la propia operación de administración del vector y se resolvieron sin intervención adicional. No se notificaron acontecimientos que limitaran la dosis. Janssen informa que en un estudio de fase III se está dosificando activamente a los pacientes.
NUEVO: EA-2353 (Endogena Therapeutics)
Endogena inició el año pasado un ensayo de fase I/IIa de EA-2353 para RP (n=14, NCT05392751). La finalización del estudio está prevista para 2025. La empresa describe el agente como un candidato novedoso de molécula pequeña que activa selectivamente las células madre y progenitoras endógenas de la retina que se diferencian en fotorreceptores. Endogena también dijo que presentaría una solicitud de nuevo fármaco en investigación (IND) ante la FDA para un ensayo con EA-2351 en AG este año. Endogena no respondió a una solicitud de información actualizada al cierre de esta edición.
Elamipretida (Stealth BioTherapeutics)
Un estudio de fase II en neuropatía óptica hereditaria de Leber (n=12, NCT02693119) concluyó y comunicó sus resultados en 2021. Dos de los 16 ojos tratados presentaban alteraciones visuales y tasas más elevadas de problemas leves de la superficie ocular que el placebo. Seis ojos tratados también presentaron cataratas leves, al igual que cinco ojos tratados primero con placebo antes de cambiar a elamipretida. La elamipretida es un péptido permeable a las células que actúa contra la disfunción mitocondrial y se administra mediante una inyección subcutánea de 40 mg. Stealth no publicó ninguna actualización sobre el programa en 2022 y no respondió a una solicitud de información actualizada.
NUEVO: Emixustat (Kubota Vision)
Emixustat modula el ciclo visual inhibiendo la proteína 65 del EPR (RPE65). La recopilación de datos se completó en el ensayo de fase III en la enfermedad de Stargardt en junio de 2022 (n=194, NCT03772665). Un análisis post hoc halló que el tratamiento con Emixustat dio lugar a una reducción del 40,8 por ciento en la progresión de las lesiones en comparación con placebo en el mes 24 frente a placebo (p=0,0206, Emixustat n=34, placebo n=21).
NUEVO: FT-001 (Frontera Therapeutics)
FT-001 es una terapia génica AAV administrada mediante una única inyección subretiniana que tiene por objeto administrar una copia funcional del gen humano RPE65 a los núcleos de las células retinianas del paciente. Frontera obtuvo el año pasado la aprobación de la solicitud de nuevo fármaco en investigación por parte de las autoridades reguladoras de Estados Unidos y China, y en enero inició un ensayo de fase I en LCA-2 en China, que no figura en ClinicalTrials.gov. Frontera afirma que espera disponer de datos a finales de este año.
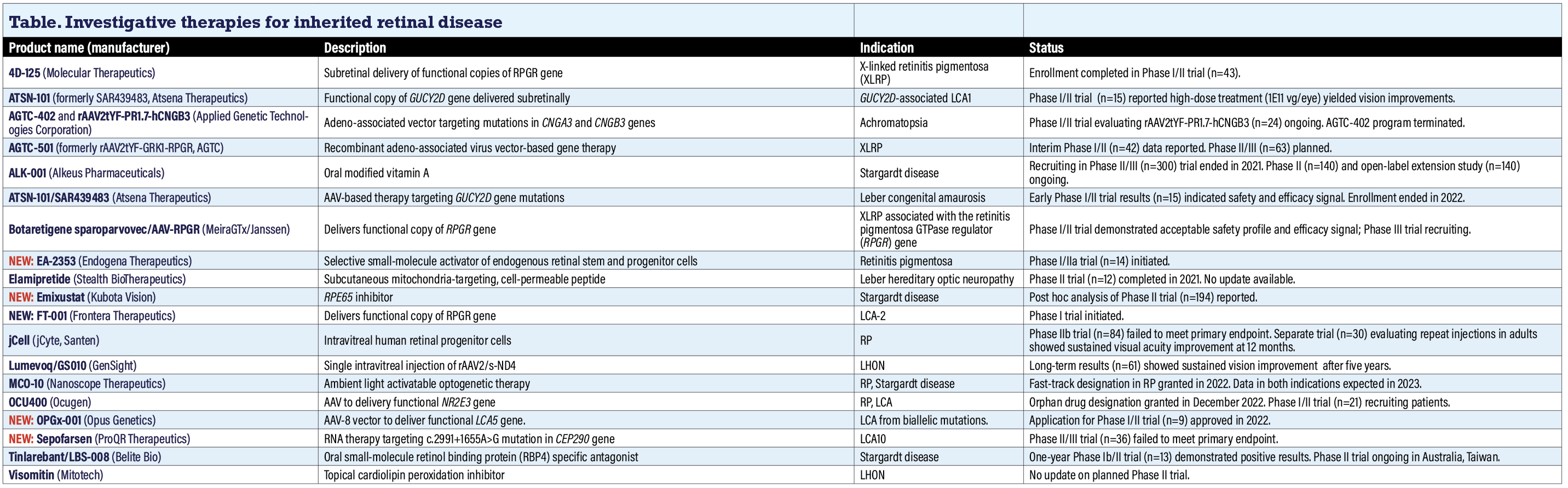
jCell (jCyte, Santen)
jCell es una inyección intravítrea de células progenitoras de la retina humana (CPRh) que tiene por objeto preservar o, potencialmente, restaurar parte de la visión en la RP y enfermedades relacionadas. El año pasado se publicaron los resultados del ensayo de fase IIb (n=84, NCT03073733) en adultos con RP. Los pacientes recibieron una dosis de 3 x 106 o 6 x 106 o una dosis placebo.
El resultado primario del ensayo fue el cambio medio en la agudeza visual mejor corregida a los 12 meses. El grupo placebo tuvo una ganancia media de letras de 3,9 (desviación estándar de 3,9) frente a 1,3 (14,14; p = 0,582) y 2,6 (21,53; p = 0,984) en los respectivos grupos de dosis. Sin embargo, un mayor porcentaje de pacientes tratados tuvo una mejora de la AV de ≥13 letras: 11,5, 16 y 30,4 por ciento para los grupos placebo y de dosis baja y alta (p=0,157). En otro ensayo se está evaluando la seguridad de las inyecciones repetidas en adultos con RP (n=30, NCT04604899).
Lumevoq/GS010 (GenSight Biologics)
En la última lectura del ensayo RESTORE de Lumevoq (lenadogene nolparvovec, n=61, NCT03406104), los participantes en el estudio con LHON debido a la mutación ND4 siguieron mostrando mejoría de la visión tras cinco años de seguimiento. Los participantes recibieron una única inyección intravítrea de rAAV2/2-ND4. RESTORE es el estudio de seguimiento a largo plazo de los ensayos de fase III RESCUE (n=39, NCT02652767) y REVERSE (n=37, NCT02652780), que demostraron una mejora sostenida de la BCVA en los pacientes tratados. GenSight afirma que prevé su aprobación en la Unión Europea para finales de año.
MCO-10 (Nanoscope Therapeutics)
Nanoscope completó la inscripción en dos ensayos para su monoterapia optogenética activada por luz ambiental: STARLIGHT, un ensayo abierto de fase II (n=6, NCT05417126) para la enfermedad de Stargardt; y un ensayo de fase IIb/III para la RP (n=27, NCT04945772).
Los datos semestrales del ensayo de Stargardt se esperan para la primavera. La FDA concedió el pasado otoño la designación rápida para la indicación de la RP. Los datos principales del ensayo de RP se esperan para la primavera.
OCU400 (Ocugen)
OCU400 (AAV-NR2E3) es una terapia génica modificada dirigida a los receptores hormonales nucleares para la RP asociada a mutaciones en el gen Nr2e3 y la rodopsina y la LCA con mutaciones en el gen Cep290, para las que la FDA concedió la designación de medicamento huérfano.
Actualmente se está reclutando a pacientes para un ensayo de fase I/II que evalúa el OCU400 (n=21, NCT05203939). El comité de seguridad y monitorización de fármacos del ensayo estableció la dosis alta de OCU400 como la dosis máxima tolerable para la fase de aumento de dosis del estudio. Se espera que el reclutamiento finalice este año.
NUEVO: OPGx-001 (Opus Genetics)
La FDA autorizó en diciembre de 2022 la solicitud IND para un ensayo de fase I/II en adultos con LCA resultante de mutaciones bialélicas en el gen LCA5 (n=9, NCT05616793). OPGx-001 es un vector AAV-8 diseñado para administrar con precisión un gen LCA5 funcional a los fotorreceptores de la retina. Se administra por vía subretiniana. Los modelos animales y humanos de células madre pluripotentes inducidas demostraron la preservación de la estructura retiniana y la función visual cuando se administró OPGx-001 antes del pico de actividad de la enfermedad. Está previsto que el ensayo finalice en 2027.
NUEVO: Sepofarsen (ProQR Therapeutics)
Sepofarsen es una terapia de ARN para la LCA10 debida a la mutación c.2991+1655A>G en el gen CEP290. ProQR estaba llevando a cabo un análisis post hoc de los datos de 12 meses del ensayo de fase II/III ILLUMINATE (n=36, NCT03913143), pero sepofarsen no alcanzó su objetivo primario de mejora de la BCVA. Un ensayo abierto de escalada de dosis de Sepofarsen para la misma indicación en niños menores de 8 años está en fase de reclutamiento (n=15, NCT04855045). En agosto de 2022, la empresa declaró que se centraría exclusivamente en el desarrollo de su tecnología de edición del ARN Axiomer y buscaría un socio estratégico para sus activos oftalmológicos, incluido el Sepofarsen.
Tinlareband/LBS-008 (Belite Bio)
Belite Bio inició el año pasado la inscripción en el ensayo clínico de fase III en EE.UU. de LBS-008, también conocido como Tinlarebant, en pacientes con la forma STGD1 de la enfermedad de Stargardt. Los resultados provisionales a un año del estudio de fase Ib/II en pacientes adolescentes con STGD1 (n=13, NCT05266014) demostraron la estabilización del grosor de la retina «en muchos sujetos», informó Belite Bio, junto con la estabilización de la visión en nueve de 13 pacientes (69,2 por ciento).3 Belite Bio también dice que está llevando a cabo un estudio de fase II de dos años, en el que se han inscrito 13 sujetos en centros clínicos de Australia y Taiwán, junto con el ensayo de fase III de dos años en adolescentes con STGD1. Ninguno de los dos aparece en Clinical Trials.gov.
Visomitin/SkQ1 (Mitotech)
Visomitin es un inhibidor tópico de la peroxidación de la cardiolipina que Mitotech también está desarrollando para tratar la enfermedad del ojo seco y el glaucoma. La FDA concedió en 2021 la designación de medicamento huérfano para el tratamiento de la LHON, y Mitotech dijo el año pasado que estaba planeando iniciar un ensayo de fase II para la indicación, pero no se ha publicado ningún ensayo en ClinicalTrials.gov. La empresa no respondió a una solicitud de información actualizada al cierre de esta edición.
REFERENCIAS
1. Kay CN. Safety and efficacy of SAR439483 in patients with Leber congenital amaurosis caused by biallelic mutations in GUCY2D (LCA1). Paper presented at the American Academy of Ophthalmology Retina Subspecialty Day; Chicago, IL; October 1, 2022.
2. Michaelides M. Ph 1/2 AAV5-RPGR (botaretigene sparoparvovec) gene therapy trial in RPGR-associate X-linked retinitis pigmentosa (XLRP). Paper presented at the American Academy of Ophthalmology Retina Subspecialty Day; Chicago, IL; October 1, 2022.
3. Grigg J. A 2-year Phase Ib/II study of the safety and tolerability of tinlarebant in adolescent STGD1 subjects: Interim findings. Paper presented at the American Academy of Ophthalmology Retina Subspecialty Day; Chicago, IL; October 1, 2022.
AUTOR: Richard Mark Kirkner.
Traducción: Asociación Mácula Retina
Fuente




